![]()
![]()
![]() Martes, 15 de marzo de 2005
| Hoy
Martes, 15 de marzo de 2005
| Hoy
SOCIEDAD › EN TRATAMIENTOS PROLONGADOS, PUEDEN PROVOCAR CANCER
Límites al uso de dos medicamentos
Se trata del Elidel y el Protopic, dos cremas para tratar la dermatitis atópica. La ANMAT seguirá la recomendación de la FDA: sólo debe usarse en mínima cantidad.
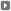 Por Pedro Lipcovich
Por Pedro Lipcovich
Dos medicamentos de uso habitual contra el eczema presentan “potencial riesgo de cáncer”, según estableció la autoridad de control de Estados Unidos (FDA), que por ese motivo estableció fuertes limitaciones para su uso. Se trata del Elidel (nombre genérico: pimecrolimus) y el Protopic (tacrolimus), que bajo esas mismas denominaciones se comercializan en la Argentina. Esta misma semana las autoridades de la ANMAT examinarán el tema y previsiblemente seguirán los pasos de la FDA. Los nuevos prospectos indicarán que estos productos pueden usarse sólo “si el paciente no responde a otros tratamientos”, sólo para tratamientos “de corto plazo e intermitentes”, “en la mínima cantidad” y nunca en menores de dos años. Los prospectos actuales, en cambio, los recomiendan para tratamientos prolongados e incluso sugieren repetir su uso “no bien reaparezcan los síntomas”. Más allá de estos casos particulares, la decisión de las autoridades sanitarias enseña sobre el hecho de que aun los medicamentos aprobados internacionalmente pueden revelar a posteriori efectos tóxicos: desde la ANMAT advierten que “especialmente durante los primeros cinco años de su aprobación conviene estar atentos a efectos que no se habían advertido”.
El Protopic (pimecrolimus) fue aprobado en 2000 por la Food & Drug Administration (FDA) de Estados Unidos; el Elidel, en 2001. Son cremas utilizadas para tratar la dermatitis atópica (eczema de piel). El 10 de marzo pasado, la FDA, tras revisar los resultados de investigaciones en tres especies animales, estableció que “el riesgo de cáncer se incrementa según la cantidad de droga administrada” y señaló “un pequeño número de reportes de cánceres en niños y adultos tratados con Elidel o Protopic”. Ambos productos, aplicados sobre una zona de la piel, controlan el eczema mediante la supresión del sistema inmunitario: esta supresión es la que se vincula con “un riesgo potencial de cáncer”. La FDA incluirá en los envases de ambos medicamentos una recomendación especial para los profesionales de la salud y una “guía de medicación” para los pacientes.
Según los nuevos lineamientos de la FDA, “Eidel y Protopic están aprobados para tratamientos de corto plazo e intermitentes de la dermatitis atópica en pacientes que no responden o no toleran otros tratamientos”; debe usarse sólo “la mínima cantidad necesaria para controlar los síntomas”; “no están aprobados para su uso en niños menores de dos años”, ya que en ensayos clínicos, chicos menores de esa edad tratados con Elidel “tuvieron más altas tasas de infecciones respiratorias” que los no tratados. Además, “su efecto a largo plazo sobre el sistema inmune en desarrollo de los niños (sin especificar edad) es desconocido”. En rigor, “la seguridad a largo plazo de ambos productos es desconocida”, advierte la FDA, y puntualiza que “chicos y adultos con el sistema inmunitario debilitado o comprometido no deben usarlos”.
En la Argentina, el prospecto del Protopic (laboratorios Gador) lo recomienda para tratamiento “a largo plazo” e incluso advierte que “si se interrumpe el tratamiento debe reanudarse no bien reaparezcan los síntomas para prevenir los brotes de la enfermedad”. Y, según el prospecto del Elidel (laboratorio Novartis), “la posología recomendada para los lactantes (3 a 23 meses) es idéntica a la de los adultos”.
La firma Novartis sostuvo que “no se ha establecido relación causal entre el uso de Elidel y el desarrollo de malignidad en más de 5 millones de pacientes” y anunció el inicio de “dos estudios a largo plazo”.
Manuel Limeres –titular de la ANMAT, organismo a cargo del control de medicamentos en la Argentina– anticipó a este diario que “esta semana el tema será tratado por la Comisión de Rótulos y Prospectos y es probable que se adopten los mismos criterios de la FDA”.
Inés Bignone –jefa de Farmacovigilancia de la ANMAT– explicó que “en especial con los medicamentos relativamente nuevos, hay que estar atentos a efectos que no se habían advertido antes de su aprobación: más de una vez debió retirarse del mercado un producto sobre la base de informaciónobtenida entre los dos y los cinco años de su comercialización. Todos los medicamentos tienen efectos adversos, y su aprobación depende del balance entre beneficios y riesgos; los efectos adversos que se presentan en muy baja proporción pueden revelarse sólo cuando, ya en el mercado, los usan grandes cantidades de individuos, o cuando se efectúan nuevos estudios, o cuando se obtienen los resultados de investigaciones a largo plazo”.
El Protopic (pimecrolimus) fue aprobado en 2000 por la Food & Drug Administration (FDA) de Estados Unidos; el Elidel, en 2001. Son cremas utilizadas para tratar la dermatitis atópica (eczema de piel). El 10 de marzo pasado, la FDA, tras revisar los resultados de investigaciones en tres especies animales, estableció que “el riesgo de cáncer se incrementa según la cantidad de droga administrada” y señaló “un pequeño número de reportes de cánceres en niños y adultos tratados con Elidel o Protopic”. Ambos productos, aplicados sobre una zona de la piel, controlan el eczema mediante la supresión del sistema inmunitario: esta supresión es la que se vincula con “un riesgo potencial de cáncer”. La FDA incluirá en los envases de ambos medicamentos una recomendación especial para los profesionales de la salud y una “guía de medicación” para los pacientes.
Según los nuevos lineamientos de la FDA, “Eidel y Protopic están aprobados para tratamientos de corto plazo e intermitentes de la dermatitis atópica en pacientes que no responden o no toleran otros tratamientos”; debe usarse sólo “la mínima cantidad necesaria para controlar los síntomas”; “no están aprobados para su uso en niños menores de dos años”, ya que en ensayos clínicos, chicos menores de esa edad tratados con Elidel “tuvieron más altas tasas de infecciones respiratorias” que los no tratados. Además, “su efecto a largo plazo sobre el sistema inmune en desarrollo de los niños (sin especificar edad) es desconocido”. En rigor, “la seguridad a largo plazo de ambos productos es desconocida”, advierte la FDA, y puntualiza que “chicos y adultos con el sistema inmunitario debilitado o comprometido no deben usarlos”.
En la Argentina, el prospecto del Protopic (laboratorios Gador) lo recomienda para tratamiento “a largo plazo” e incluso advierte que “si se interrumpe el tratamiento debe reanudarse no bien reaparezcan los síntomas para prevenir los brotes de la enfermedad”. Y, según el prospecto del Elidel (laboratorio Novartis), “la posología recomendada para los lactantes (3 a 23 meses) es idéntica a la de los adultos”.
La firma Novartis sostuvo que “no se ha establecido relación causal entre el uso de Elidel y el desarrollo de malignidad en más de 5 millones de pacientes” y anunció el inicio de “dos estudios a largo plazo”.
Manuel Limeres –titular de la ANMAT, organismo a cargo del control de medicamentos en la Argentina– anticipó a este diario que “esta semana el tema será tratado por la Comisión de Rótulos y Prospectos y es probable que se adopten los mismos criterios de la FDA”.
Inés Bignone –jefa de Farmacovigilancia de la ANMAT– explicó que “en especial con los medicamentos relativamente nuevos, hay que estar atentos a efectos que no se habían advertido antes de su aprobación: más de una vez debió retirarse del mercado un producto sobre la base de informaciónobtenida entre los dos y los cinco años de su comercialización. Todos los medicamentos tienen efectos adversos, y su aprobación depende del balance entre beneficios y riesgos; los efectos adversos que se presentan en muy baja proporción pueden revelarse sólo cuando, ya en el mercado, los usan grandes cantidades de individuos, o cuando se efectúan nuevos estudios, o cuando se obtienen los resultados de investigaciones a largo plazo”.
Las cremas Elidel y Protopic sólo deben usarse en tratamientos cortos.
SOCIEDAD
indice
-
EN TRATAMIENTOS PROLONGADOS, PUEDEN PROVOCAR CANCER
Límites al uso de dos medicamentos
Por Pedro Lipcovich -
EL PRESIDENTE DE SOUTHERN WINDS FUE INDAGADO POR EL JUEZ
“Fui tomado como narcotraficante”
Por Alejandra Dandan -
UN CHICO CONTO QUE EL PAPA
MATO Y ENTERRO BAJO LA CAMA A SU MAMA
La confesión que tardó ocho años
Por Carlos Rodríguez -
UN SOBRINO ENTREGO A SUS TIOS PARA UN ASALTO
El mensaje de texto delator -
La historia de un joven adicto que no pudo ser salvado por una demora
Por Andrea Ferrari - Juicio en el caso Blumberg
-
“Los rellenos sanitarios son la mejor solución para la basura”
Por Eduardo Videla
ESCRIBEN HOY
- Alejandra Dandan
- Andrea Ferrari
- Carlos Rodríguez
- Claudio Scaletta
- Cledis Candelaresi
- Diego Bonadeo
- Eduardo Tagliaferro
- Eduardo Videla
- Emanuel Respighi
- Fabián Lebenglik
- Javier Lorca
- Julián Gorodischer
- Karina Micheletto
- Mariano Blejman
- Martín Pérez
- Pablo Vignone
- Pedro Lipcovich
- Raúl Kollmann
- Victoria Ginzberg
© 2000-2022 www.pagina12.com.ar | República Argentina | Política de privacidad | Todos los Derechos Reservados
Sitio desarrollado con software libre GNU/Linux.






