![]()
![]()
![]() Jueves, 7 de octubre de 2004
| Hoy
Jueves, 7 de octubre de 2004
| Hoy
Premio por descubrir cómo se reciclan las proteínas
Dos científicos israelíes y un estadounidense recibieron el Premio Nobel de Química por haber descubierto, en los años ‘80, el ciclo de degradación regulada de las proteínas.
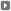 Por Federico Kukso
Por Federico Kukso
Si el siglo XX bajó sus persianas cantando loas al genoma (y a su proyecto), el siglo XXI despunta con un estridente reconocimiento al rol desempeñado por unas macromoléculas fundamentales para la vida: las proteínas, término que proviene del griego, “de importancia primordial”. Esas sustancias son las que forman la estructura física de los organismos vivos y las que les permiten funcionar al determinar, por ejemplo, cómo el cuerpo se defiende ante la presencia de infecciones virales o cómo ha de metabolizar los alimentos. Ahí están las famosas hemoglobina, insulina y los anticuerpos. La prueba más contundente de la importancia asignada a su estudio tal vez sea la miríada de premios Nobel que se vienen entregando a aquellos científicos imbuidos en su análisis y desciframiento, si bien su estructura y funciones comenzaron a describirse allá por los ‘60. Este año, la tendencia no se interrumpió y el Premio Nobel de Química cayó en las manos de los bioquímicos israelíes Aaron Ciechanover y Avram Hershko, ambos del Technion –Instituto de Tecnología de Israel– en Haifa, y del estadounidense Irwin Rose (Universidad de California) por “haber descubierto en los años ‘80 la degradación regulada de las proteínas, uno de los más importantes procesos cíclicos de la célula”, según anunció ayer la Real Academia Sueca de Ciencias.
El asunto es así: todo organismo vivo, desde las bacterias a las ballenas, cuenta con un número variable de proteínas que constituyen más del 50 por ciento del peso de sus células y que llevan a cabo miles de tareas para que el cuerpo siga con vida. Forman huesos y músculos, guían el crecimiento y el desarrollo del embrión al organismo completo. En el ser humano, por ejemplo, se conocen unas cien mil proteínas, cada una de ellas formadas por unos ladrillitos: los “aminoácidos”. En total, hay unos 20 aminoácidos básicos y cada proteína tiene un número variable de ellos. Pueden componerlas 300, 400 o 500 aminoácidos, en diferente orden. Y así, las combinaciones pueden ser asombrosas.
Ahora bien, las proteínas –compuestas por carbono, hidrógeno, oxígeno y nitrógeno– no son eternas. Nacen (o, mejor dicho, son fabricadas o sintetizadas como consecuencia del trabajo en conjunto del ADN y del ARN, que ensamblan los aminoácidos como las piezas de un Lego), cumplen su función y necesariamente deben ser eliminadas o degradadas a los aminoácidos que las componen. De manera que la vida media de las proteínas va desde muy pocos minutos hasta semanas o en algunos casos meses. Cada día, en el cuerpo humano se descomponen unos 300 gramos de proteínas. Es un ciclo de reciclaje, como descubrieron Ciechanover, Hershko y Rose, orquestado con la más delicada precisión suiza. Hay una razón: de no degradarse correctamente las proteínas, se corre el riesgo de que toda la economía celular entre en default y de que aparezcan así enfermedades como cáncer cervical o fibrosis cística, entre otras.
Aun antes del desciframiento de la estructura del ADN, en 1953, por James Watson y Francis Crick, las proteínas ya eran detalladamente desglosadas. Primero se encaró el estudio de su estructura y de las múltiples maneras de identificarla. Lo que faltaba, sin embargo, era dar con la intrincada manera en que la célula las hace añicos en procesos como la división celular, la reparación del ADN, la producción de nuevas proteínas y la defensa inmunitaria del organismo.
Ahí aparecieron los dos israelíes y el norteamericano, y la incógnita quedó disipada. “Lo que encontró esta gente fue un mecanismo muy general: de qué manera la célula ‘marca’ molecularmente a la proteína con una especie de etiqueta química llamada ubiquitina para que sea eliminada. Entonces, las proteínas son modificadas por esta molécula especial –que también es una proteína en sí, muy chiquitita–, para emprender viaje hacia unos orgánulos llamados proteasomas, una especie de `basureros’ de las células, que las corta en pedacitos y las destruye”, explicó aPágina/12 el químico Julio Caramelo, del Laboratorio de Glicobiología de la Fundación Instituto Leloir.
Ahora famosa, la ubiquitina –formada por 76 aminoácidos– fue aislada recién en 1975. No sólo es muy abundante, sino que se la encontró en numerosos tejidos y organismos (con excepción de las bacterias), hecho que le hizo ganar su nombre, que viene justamente de “ubicuo”, o sea, “en todas partes”. Además, se la considera la proteína más conservada en la evolución, dado que se la puede encontrar, con la misma mochila de aminoácidos, en una mosca, un perro, una rana o en el hombre.
En verdad, desde hace cinco años se cree que la suerte nobelística se inclinaría hacia el lado de Ciechanover, Hershko y Rose. Para el químico Armando José Parodi, director del Laboratorio de Glicobiología de la Fundación Instituto Leloir, “es un Nobel que debería haber sido dado hace bastantes años, ya que el descubrimiento de Ciechanover y Hershko es fundamental en biología básica”. Lo cual demuestra una y otra vez que lo bueno efectivamente tarda en llegar.
El asunto es así: todo organismo vivo, desde las bacterias a las ballenas, cuenta con un número variable de proteínas que constituyen más del 50 por ciento del peso de sus células y que llevan a cabo miles de tareas para que el cuerpo siga con vida. Forman huesos y músculos, guían el crecimiento y el desarrollo del embrión al organismo completo. En el ser humano, por ejemplo, se conocen unas cien mil proteínas, cada una de ellas formadas por unos ladrillitos: los “aminoácidos”. En total, hay unos 20 aminoácidos básicos y cada proteína tiene un número variable de ellos. Pueden componerlas 300, 400 o 500 aminoácidos, en diferente orden. Y así, las combinaciones pueden ser asombrosas.
Ahora bien, las proteínas –compuestas por carbono, hidrógeno, oxígeno y nitrógeno– no son eternas. Nacen (o, mejor dicho, son fabricadas o sintetizadas como consecuencia del trabajo en conjunto del ADN y del ARN, que ensamblan los aminoácidos como las piezas de un Lego), cumplen su función y necesariamente deben ser eliminadas o degradadas a los aminoácidos que las componen. De manera que la vida media de las proteínas va desde muy pocos minutos hasta semanas o en algunos casos meses. Cada día, en el cuerpo humano se descomponen unos 300 gramos de proteínas. Es un ciclo de reciclaje, como descubrieron Ciechanover, Hershko y Rose, orquestado con la más delicada precisión suiza. Hay una razón: de no degradarse correctamente las proteínas, se corre el riesgo de que toda la economía celular entre en default y de que aparezcan así enfermedades como cáncer cervical o fibrosis cística, entre otras.
Aun antes del desciframiento de la estructura del ADN, en 1953, por James Watson y Francis Crick, las proteínas ya eran detalladamente desglosadas. Primero se encaró el estudio de su estructura y de las múltiples maneras de identificarla. Lo que faltaba, sin embargo, era dar con la intrincada manera en que la célula las hace añicos en procesos como la división celular, la reparación del ADN, la producción de nuevas proteínas y la defensa inmunitaria del organismo.
Ahí aparecieron los dos israelíes y el norteamericano, y la incógnita quedó disipada. “Lo que encontró esta gente fue un mecanismo muy general: de qué manera la célula ‘marca’ molecularmente a la proteína con una especie de etiqueta química llamada ubiquitina para que sea eliminada. Entonces, las proteínas son modificadas por esta molécula especial –que también es una proteína en sí, muy chiquitita–, para emprender viaje hacia unos orgánulos llamados proteasomas, una especie de `basureros’ de las células, que las corta en pedacitos y las destruye”, explicó aPágina/12 el químico Julio Caramelo, del Laboratorio de Glicobiología de la Fundación Instituto Leloir.
Ahora famosa, la ubiquitina –formada por 76 aminoácidos– fue aislada recién en 1975. No sólo es muy abundante, sino que se la encontró en numerosos tejidos y organismos (con excepción de las bacterias), hecho que le hizo ganar su nombre, que viene justamente de “ubicuo”, o sea, “en todas partes”. Además, se la considera la proteína más conservada en la evolución, dado que se la puede encontrar, con la misma mochila de aminoácidos, en una mosca, un perro, una rana o en el hombre.
En verdad, desde hace cinco años se cree que la suerte nobelística se inclinaría hacia el lado de Ciechanover, Hershko y Rose. Para el químico Armando José Parodi, director del Laboratorio de Glicobiología de la Fundación Instituto Leloir, “es un Nobel que debería haber sido dado hace bastantes años, ya que el descubrimiento de Ciechanover y Hershko es fundamental en biología básica”. Lo cual demuestra una y otra vez que lo bueno efectivamente tarda en llegar.
Los bioquímicos Aaron Ciechanover y Avram Hershko, de Israel.
SOCIEDAD
indice
-
LA HIJA DE UN MINISTRO INVENTO LA HISTORIA PARA FALTAR A CLASE
Un falso secuestro sacudió a Chubut - Elevado pedido de rescate
-
LIBERAN A DOS ARGENTINOS RAPTADOS
Cuento del tío a la brasileña
Por Pedro Lipcovich -
EL SENADO DIO MEDIA SANCION A LA LEY DE DROGAS QUE IMPULSA SOLA
Tráfico minorista, para la provincia
Por Eduardo Tagliaferro -
LOS FUNDAMENTOS DEL CASO STRAJMAN
Contra leyes duras -
A PARTIR DE HOY TOMARAN LISTA EN LA ESCUELA DONDE SE DESATO LA TRAGEDIA
Para saber quién teme regresar al aula -
“No hay que confundir violencia y locura con la violencia escolar”
Por Nora Veiras -
Premio por descubrir cómo se reciclan las proteínas
Por Federico Kukso -
RELEVAMIENTO EN ESCUELAS PORTEÑAS
A cambiar los vidrios
ESCRIBEN HOY
- Adriana Meyer
- Claudio Zlotnik
- Cledis Candelaresi
- Cristian Vitale
- Diego Fischerman
- Eduardo Tagliaferro
- Federico Kukso
- Horacio Bernades
- Javier Aguirre
- Javier Lorca
- José Natanson
- Laura Vales
- Luciano Monteagudo
- Mariano Blejman
- Mario Wainfeld
- Martín Granovsky
- Maximiliano Montenegro
- Nora Veiras
- Pedro Lipcovich
- Raúl Kollmann
- Roque Casciero
- Santiago Rial Ungaro
- Santiago Rodríguez
- Silvina Friera
© 2000-2022 www.pagina12.com.ar | República Argentina | Política de privacidad | Todos los Derechos Reservados
Sitio desarrollado con software libre GNU/Linux.






