![]()
![]()
![]() Sábado, 16 de marzo de 2002
| Hoy
Sábado, 16 de marzo de 2002
| Hoy
SOCIEDAD › UN EXPERTO AUSTRALIANO EXPLICA EL FUTURO DE LAS CELULAS MADRE
La nueva forma de curar enfermedades
Uno de los creadores de la fertilización asistida, Alan Trounson, investiga ahora las células madre, que pueden abrir una nueva era en la lucha contra diversos males. De visita en Buenos Aires, contó a Página/12 el curso de la investigación y reveló que ya hay plazos para los ensayos en seres humanos.
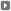 Por Pedro Lipcovich
Por Pedro Lipcovich
Lo más impresionante es ver, latiendo, carne de corazón inventada por el hombre. Pero, también, células de retina para curar la ceguera, pancreáticas para curar la diabetes, sanguíneas para la leucemia y hasta nerviosas para enfrentar, un día, al Parkinson y al Alzheimer. Las células cardíacas, que han de servir para rehabilitar a los infartados, se ven latir en el video que el australiano Alan Trounson presentó ayer en su visita a Buenos Aires. El científico, uno de los padres de las técnicas de fertilización asistida, se dedica ahora a la investigación de las stem cells, células que, recogidas en los primeros estadios del desarrollo del embrión –tomado a su vez de los que se descartan en la fecundación in vitro–, tienen la potencialidad de generar prácticamente todos los tejidos del organismo. Trounson explicó a Página/12 cómo se logra esto, reveló las últimas novedades de la técnica y anunció cuándo y cómo empezarán los primeros ensayos con seres humanos.
El investigador, que en la década de los ‘80 puso a punto la técnica de criopreservación de embriones para fertilización asistida, llegó a Buenos Aires para participar en las Jornadas Internacionales sobre Reproducción Asistida organizadas por la Sociedad Argentina de Esterilidad y Fertilidad (SAEF). ¿Cómo se hace para convertir un puñado de stem cells en, por ejemplo, tejido cardíaco? “Se las pone a crecer en contacto con tejido cardíaco de ratón: las células totipotenciales tienden a transformarse en células del mismo tipo que el tejido en el que se las ha incluido”,
explica el investigador. Y la cosa no termina ahí: “Buscamos qué proteína caracteriza a ese tejido y, a partir de eso, tratamos de encontrar qué gen, en el ser humano, gobierna la producción de esa proteína”. Ya se sabe que todas las células del organismo son genéticamente idénticas: que resulten de un tipo u otro depende de qué genes se “enciendan”, se activen en ellas.
Claro que el proceso de fabricar tejido cardíaco es más complejo, e incluye el cultivo de las células con determinados factores de crecimiento y no otros. El resultado es no sólo células cardíacas sino un músculo sano que se pone a latir en las placas de cultivo. “Estas células cardíacas humanas, aplicadas a ratones que hayan sufrido un infarto, colonizan el tejido infartado, que así puede volver a latir”, cuenta Trounson. ¿Cómo se hará para llevar estas células al corazón del paciente? Simplemente inyectándolas en una vena: en el torrente sanguíneo, ellas solas se fijarán en el tejido al que están destinadas.
“Creemos que también vamos a poder curar la ceguera, la diabetes, enfermedades del sistema nervioso como el Parkinson y el Alzheimer, la fibrosis quística”, anuncia el investigador australiano. La ceguera: “Desarrollando células retinianas y colocándolas directamente en el ojo”; la fibrosis quística: “Generando tejido pulmonar”. La curación de la diabetes, a esta altura, parece fácil: bastaría con conducir stem cells a que se conviertan en las células del páncreas que producen insulina. También los tumores malignos podrían atacarse, transformando las células embrionarias en glóbulos blancos killer, programados para tomar los tumores como objetivo.
En cuanto al sistema nervioso central, “hemos desarrollado neuronas humanas a partir de stem cells: cuando las inyectamos en el sistema nervioso central de ratas, repoblaron todo el cerebro, generando distintas clases de neuronas”, relata Trounson. Uno podría llegar a inquietarse ante la idea de esas ratas con neurona humana, pero tal vez no sean las primeras. Hay otra cuestión: los ratones no rechazan los tejidos injertados porque los científicos han anulado previamente su sistema inmunitario pero, en los humanos, ¿no producirían rechazo estos tejidos desarrollados en laboratorio?
“Sí –admite el científico australiano–, pero ese rechazo puede combatirse. Por ejemplo, generando hasta cuatrocientas líneas distintas de stem cells, eligiendo la que sea más compatible con el paciente yadministrando drogas inmunosupresoras”; es decir, logrando una situación similar a la de la persona que recibe un trasplante de órgano de un donante compatible.
Pero, tratándose de stem cells, hay otras formas de combatir el riesgo de rechazo y una de ellas es interesantísima: “La clonación terapéutica: tomar células de la piel del paciente, reemplazar por su material genético el de stem cells y lograr así un embrión genéticamente idéntico al de esa persona, a partir del cual podrán desarrollarse tejidos específicamente para ella”.
¿Y cuándo empezarán los ensayos sobre seres humanos? “Quizás en tres o cuatro años, para grupos reducidos experimentales. Lo primero en ensayarse sería el tratamiento de leucemias o linfomas, para los cuales se cuenta con una sólida base de experiencia clínica en trasplantes de médula; después podría probarse la producción de piel nueva en pacientes con quemaduras, por ejemplo aplicando las células cutáneas en forma de tópicos. Los ensayos contra Parkinson o Alzheimer serían los últimos, porque inyectar células en el cerebro plantea problemas de seguridad más complicados.” Entre medio, vendrían los ensayos de la inyección para curar los efectos del infarto, “dentro de cinco años, siete, quién sabe; estas cosas suceden cada vez más rápido”, comenta Alan Trounson.
El investigador, que en la década de los ‘80 puso a punto la técnica de criopreservación de embriones para fertilización asistida, llegó a Buenos Aires para participar en las Jornadas Internacionales sobre Reproducción Asistida organizadas por la Sociedad Argentina de Esterilidad y Fertilidad (SAEF). ¿Cómo se hace para convertir un puñado de stem cells en, por ejemplo, tejido cardíaco? “Se las pone a crecer en contacto con tejido cardíaco de ratón: las células totipotenciales tienden a transformarse en células del mismo tipo que el tejido en el que se las ha incluido”,
explica el investigador. Y la cosa no termina ahí: “Buscamos qué proteína caracteriza a ese tejido y, a partir de eso, tratamos de encontrar qué gen, en el ser humano, gobierna la producción de esa proteína”. Ya se sabe que todas las células del organismo son genéticamente idénticas: que resulten de un tipo u otro depende de qué genes se “enciendan”, se activen en ellas.
Claro que el proceso de fabricar tejido cardíaco es más complejo, e incluye el cultivo de las células con determinados factores de crecimiento y no otros. El resultado es no sólo células cardíacas sino un músculo sano que se pone a latir en las placas de cultivo. “Estas células cardíacas humanas, aplicadas a ratones que hayan sufrido un infarto, colonizan el tejido infartado, que así puede volver a latir”, cuenta Trounson. ¿Cómo se hará para llevar estas células al corazón del paciente? Simplemente inyectándolas en una vena: en el torrente sanguíneo, ellas solas se fijarán en el tejido al que están destinadas.
“Creemos que también vamos a poder curar la ceguera, la diabetes, enfermedades del sistema nervioso como el Parkinson y el Alzheimer, la fibrosis quística”, anuncia el investigador australiano. La ceguera: “Desarrollando células retinianas y colocándolas directamente en el ojo”; la fibrosis quística: “Generando tejido pulmonar”. La curación de la diabetes, a esta altura, parece fácil: bastaría con conducir stem cells a que se conviertan en las células del páncreas que producen insulina. También los tumores malignos podrían atacarse, transformando las células embrionarias en glóbulos blancos killer, programados para tomar los tumores como objetivo.
En cuanto al sistema nervioso central, “hemos desarrollado neuronas humanas a partir de stem cells: cuando las inyectamos en el sistema nervioso central de ratas, repoblaron todo el cerebro, generando distintas clases de neuronas”, relata Trounson. Uno podría llegar a inquietarse ante la idea de esas ratas con neurona humana, pero tal vez no sean las primeras. Hay otra cuestión: los ratones no rechazan los tejidos injertados porque los científicos han anulado previamente su sistema inmunitario pero, en los humanos, ¿no producirían rechazo estos tejidos desarrollados en laboratorio?
“Sí –admite el científico australiano–, pero ese rechazo puede combatirse. Por ejemplo, generando hasta cuatrocientas líneas distintas de stem cells, eligiendo la que sea más compatible con el paciente yadministrando drogas inmunosupresoras”; es decir, logrando una situación similar a la de la persona que recibe un trasplante de órgano de un donante compatible.
Pero, tratándose de stem cells, hay otras formas de combatir el riesgo de rechazo y una de ellas es interesantísima: “La clonación terapéutica: tomar células de la piel del paciente, reemplazar por su material genético el de stem cells y lograr así un embrión genéticamente idéntico al de esa persona, a partir del cual podrán desarrollarse tejidos específicamente para ella”.
¿Y cuándo empezarán los ensayos sobre seres humanos? “Quizás en tres o cuatro años, para grupos reducidos experimentales. Lo primero en ensayarse sería el tratamiento de leucemias o linfomas, para los cuales se cuenta con una sólida base de experiencia clínica en trasplantes de médula; después podría probarse la producción de piel nueva en pacientes con quemaduras, por ejemplo aplicando las células cutáneas en forma de tópicos. Los ensayos contra Parkinson o Alzheimer serían los últimos, porque inyectar células en el cerebro plantea problemas de seguridad más complicados.” Entre medio, vendrían los ensayos de la inyección para curar los efectos del infarto, “dentro de cinco años, siete, quién sabe; estas cosas suceden cada vez más rápido”, comenta Alan Trounson.

Alan Trounson participa en Buenos Aires de las Jornadas Internacionales sobre Reproducción Asistida.
SUBNOTAS
- Investigación con polémica
Por Pedro Lipcovich
SOCIEDAD
indice
-
UN EXPERTO AUSTRALIANO EXPLICA EL FUTURO DE LAS CELULAS MADRE
La nueva forma de curar enfermedades
Por Pedro Lipcovich -
DONACIONES DE REMEDIOS AL PAIS
Campaña por la salud - Un informe oficial británico propone ablandar la ley contra el cannabis
-
TREINTA JUECES SE REUNIERON CON LA CORTE POR LOS CHICOS PRESOS
“Siguen el maltrato y los apremios” - Cincuenta heridos en Ezeiza al chocar un tren y una locomotora
-
DOS PRESOS POR UN ROBO FRUSTRADO
Trotyl al banco
ESCRIBEN HOY
- Adriana Meyer
- Cecilia Hopkins
- Claudio Zlotnik
- Cledis Candelaresi
- David Cufré
- Emanuel Respighi
- Esteban Pintos
- Felipe Yapur
- Horacio Bernades
- J. M. Pasquini Durán
- José Natanson
- Julio Nudler
- Laura Vales
- Leonardo Moledo
- Martín Pérez
- Osvaldo Bayer
- Pedro Lipcovich
- Raúl Kollmann
- Rodrigo Fresán
- Santiago Rodríguez
- Sergio Kiernan
- Verónica Abdala
© 2000-2022 www.pagina12.com.ar | República Argentina | Política de privacidad | Todos los Derechos Reservados
Sitio desarrollado con software libre GNU/Linux.






